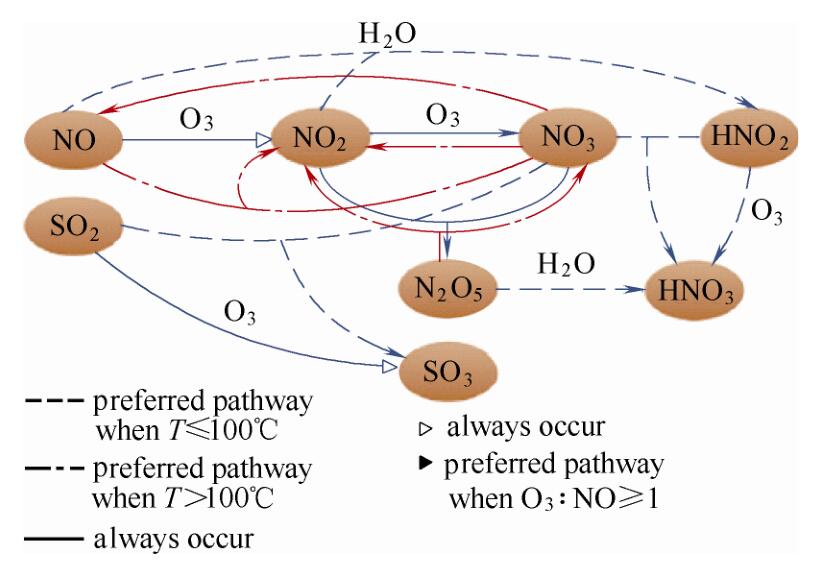
区别于还原法脱硝技术,臭氧氧化脱硝技术将NO氧化为易溶于水的NO2和N2O5等,结合后续吸收工艺进行脱硝。臭氧氧化脱硝技术已经广泛应用于催化裂化、工业锅炉烟气NOx排放控制。
结合臭氧氧化技术的工艺特点及反应动力学,分析了复杂烟气组分中NO氧化的选择性,重点关注臭氧与NO摩尔比、反应温度和停留时间等关键工艺参数对氧化产物组成的影响。
通过阐述湿法与半干法脱硫工艺中的硫硝协同吸收原理,分析吸收剂、吸收气体组成、添加剂等因素对吸收效率的影响。
在此基础上,提出臭氧氧化脱硝技术研究中存在的不足以及此技术未来的发展前景。
氮氧化物会造成环境污染,是形成酸雨和光化学烟雾等的主要污染物之一。我国工业固定源NOx排放占NOx排放总量的70%左右。
目前工业烟气NOx排放控制技术主要有选择性催化还原技术(ive catalytic reduction,SCR)、活性炭吸附技术。
SCR技术在燃煤锅炉烟气脱硝中具有广泛应用,该技术是在300~温度范围内,NH3和催化剂的共同作用下,将烟气中的NOx还原成N2,脱硝效率一般在85%以上。
活性炭吸附技术利用活性炭的吸附性能将NOx吸附脱除,同时通入NH3可使NOx在活性炭表面发生催化还原反应生成N2。
烟气中90%以上的NOx为NO,其在水中溶解度较低(小于/dm3),无法被脱硫系统有效吸收。
与NO相比,NO2和N2O5在水中溶解度分别为/dm3和/dm3,更容易被吸收。氧化吸收技术将难溶于水的NO氧化为高价态NOx,利用高价态NOx易溶的特性,借助原有的SO2吸收工艺脱硝。
相比于SCR和活性炭吸附技术,氧化吸收技术能够利用已有设施,且不会存在脱硝效率随运行时间延长逐渐下降的问题。
目前报道较多的氧化方法有非热等离子体氧化、电子束烟气处理、光催化等以及使用O3、NaClO2、NaClO、H2O2、ClO2和KMnO4等氧化剂直接氧化NO。
综合来看,O3具有低温条件下氧化效率高、氧化选择性强、氧化产物无二次污染的优点。因此,臭氧作为NOx氧化剂的优势明显。
臭氧氧化吸收脱硝工艺中最著名的为LoTOx臭氧氧化脱硝技术。此技术最早在20世纪90年代由林德BOC公司开发,之后与杜邦BELCO公司的EDV湿法洗涤脱硫技术结合形成LoTOx-EDV技术,即臭氧氧化-湿法洗涤脱硝工艺。
目前LoTOx-EDV技术已经在石油化工行业中大量应用。例如,中石油四川石化、中石化金陵石化、中石化齐鲁石化和中石化扬子石化等在(250~350)×104t/a FCC装置采用相同技术,处理烟气量为(25~50)×104m3/h,出口氮氧化物浓度为20~30 mg/m3,脱硝效率达到90%。
该脱硝技术的关键是采用O3在温度较低的条件下将NOx氧化为N2O5,然后通过EDV洗涤装置实现NOx的高效吸收。
该技术应用于其他行业烟气处理时,可能存在的问题包括:
(1)复杂的烟气成分中同时含有SO2、CO、H2O等多种物质,LoTOx工艺在60~进行低温氧化,O3对NOx氧化的选择性较强,随着工艺条件改变,氧化温度升高,需要重新分析氧化选择性;
(2)不同价态的NOx在脱硫系统中的吸收能力不同,需要研究不同工艺条件下氧化产物的分布组成规律;
(3)NO2有一定的溶解度,但脱硫系统对NO2的吸收效率明显低于N2O5。因此,需要对NOx的氧化和吸收过程进行详尽分析,得到不同影响因素的作用原理,从而提高吸收效率、降低运行成本。
下面主要针对臭氧氧化吸收脱硝技术进行综述,重点介绍O3对NOx的选择性氧化机制、氧化产物调控技术和硫硝高效协同吸收技术。
分析O3与烟气中多组分的反应动力学研究结果,O3/NO摩尔比、温度、停留时间对氧化效率及氧化产物的影响,湿法吸收和半干法吸收的原理以及吸收液种类、吸收气体组成、添加剂种类等因素对吸收效率的影响,总结控制和提高NOx脱硝效率的途径。
1、复杂烟气组分中臭氧对NOx的选择性氧化
臭氧具备强氧化性,能够快速地将NO氧化为NO2,但性质不稳定,有半衰期,且受热易分解。将臭氧应用在工业氧化脱硝之中,需要明确臭氧在不同工况条件下的分解率,避免臭氧分解过多。
臭氧作为氧化剂时需要适当的反应温度区间。例如在臭氧的热分解特性研究中,在温度为20℃时,在10s内O3的分解率为0.5%,温度为150℃时,10s内O3的分解率为20%,温度为200℃时,1s内O3的分解率就达到40%。
因此为了提高O3的利用率,反应温度低于200℃被认为最适合应用于臭氧氧化脱硝,这一特性也决定了臭氧氧化脱硝技术的适用工艺为烟气温度低于200℃的工况。臭氧氧化工业烟气反应机理非常复杂,涉及多种物质的氧化反应,每种物质又有许多中间态反应和氧化产物的分解反应等。
2006年,Mok等得到12步臭氧氧化氮氧化物的反应机理,只涉及了其中几个主要反应。2006年,Wang等通过数值模拟得到臭氧与氮氧化物的65步反应机理,但其中并没有涉及有关NO3的反应,有研究表明NO3不会稳定存在,然而在NOx氧化过程中是关键的一环。
由于O3不仅可以氧化NOx,对烟气中其他成分可能也有一定的氧化作用,2007年,Wei等提出了臭氧氧化多种污染物的动力学模型,其中包含O3与CO、Hg、H2O、NO、NO2、O2、SO2、H2S等多种物质的反应过程。
2016年,Wang等通过数值模拟补充了涉及NO3的相关反应,完善了臭氧氧化NO的反应机理。以上反应机理的提出,基本囊括了臭氧氧化工业烟气涉及的所有反应。
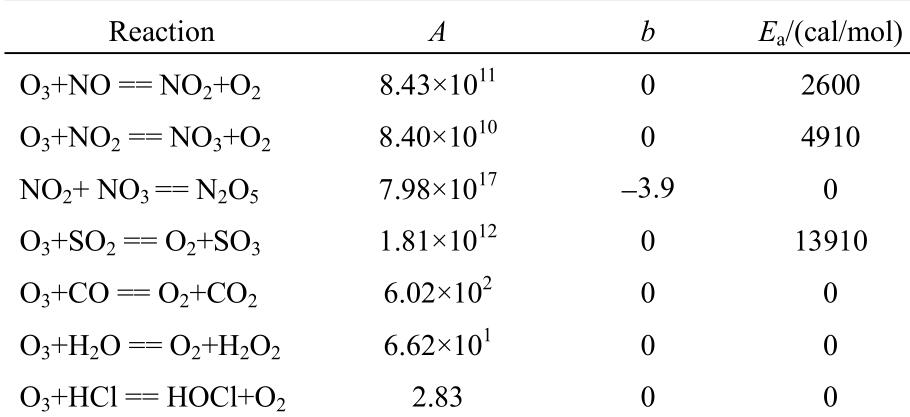
表 1 反应动力学参数
表1列出了O3氧化工业烟气过程中几个主要的基元反应,反应动力学参数取自美国标准研究所NIST数据库,其中反应速率常数为
通过反应动力学参数可以看出,O3氧化NOx反应机理中NO2的生成速率、N2O5的生成速率都大于O3氧化NO2生成NO3的速率,而且O3氧化NO2形成的NO3很容易与NO2结合生成N2O5,因此O3氧化NO的最终氧化产物为NO2和N2O5。
O3氧化NO的反应速率远大于O3氧化SO2、CO、HCl和H2O等物质的反应速率,动力学参数反映出O3对复杂烟气组分的氧化可能会表现出一定的选择性。
Sun等通过实验得到臭氧氧化NOx和SO2反应过程如图1所示。
图 1 臭氧氧化NOx和SO2主要反应机理
LoTOx工艺中反应温度为60~70℃,此温度下无SO2氧化问题,但是随着工艺条件改变,反应温度升高,O3氧化SO2的反应速率也会相对提高。臭氧氧化SO2不仅增加了O3的消耗,而且氧化产物为SO3,易与烟气中的水分结合生成硫酸雾气溶胶,对设备具有腐蚀性且会在大气中形成细颗粒物(PM2.5),加重雾霾污染。因此必须明确SO3在O3氧化NOx过程中的形成规律。
目前关于臭氧氧化NOx过程中对SO2影响的研究较少,Zhang等和Guo等认为在80~100℃时,SO2氧化率特别小,反应温度达到150℃时,SO2氧化率在5%左右。实验采用Optima7烟气分析仪作为检测仪器,该仪器只能检测SO2,但无法检测SO3,导致检测结果存在缺陷。
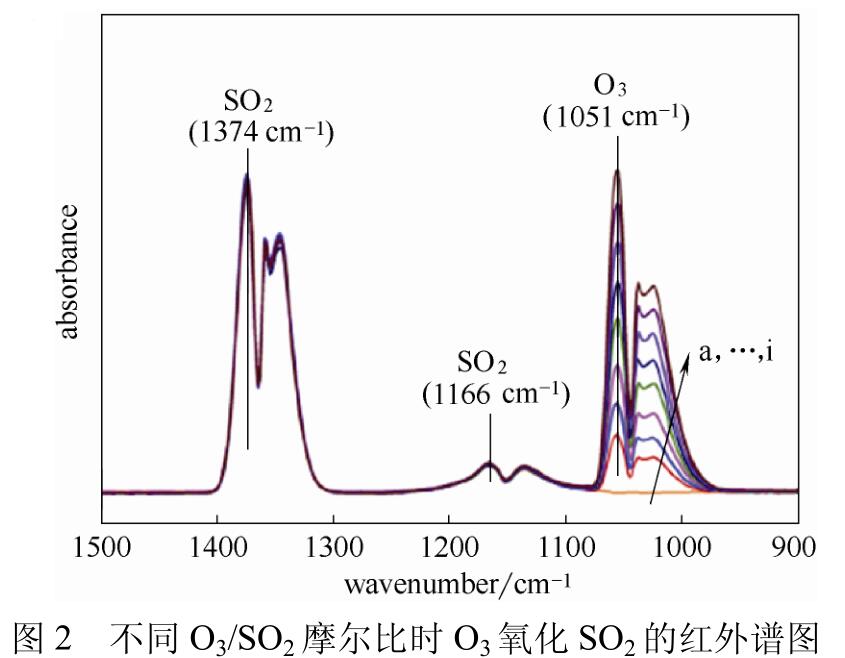
Sun等用红外光谱进行检测,实验结果如图2所示,在实验温度为80℃时,对比了不同O3/SO2摩尔比条件下SO2红外峰面积的变化量,发现SO2的红外峰面积基本没变化,他们认为SO2氧化率很小,产生的SO3也很少。
但他们并没有得到具体SO2的氧化率数值,认为SO2基本不会被氧化,也没有实验数据证明SO3的生成量。分析实验过程发现目前的研究中均是通过检测SO2的减少量来判断SO2氧化率,而没有直接检测到SO3生成量。从以上实验结论可以看出,关于臭氧氧化NOx过程中SO2氧化率的研究尚不成熟,需要对此问题进行深入研究。
2、氧化产物组成的影响因素
O3与NO的反应过程较为复杂,氧化程度及氧化产物组成与反应条件密切相关。由于不同价态NOx物理化学性质的差异,溶液更容易吸收高价态NOx。因此,为了实现吸收效率可调节,需要研究工艺参数对氧化产物组成的影响,其影响因素主要有:O3/NO摩尔比、反应温度、停留时间等。
2.1 O3/NO摩尔比
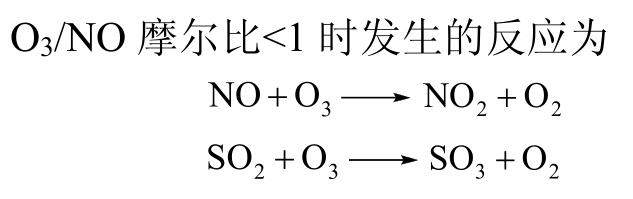
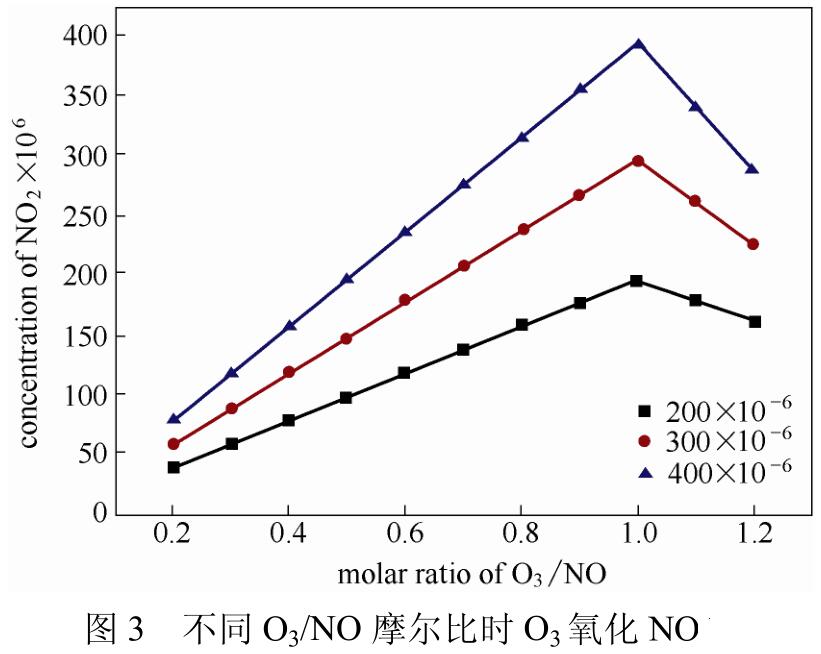
Sun等通过红外检测反应温度为80℃时,不同O3/NO摩尔比条件下的氧化产物,发现当O3/NO摩尔比<1时,NO的氧化产物为NO2,且NO氧化效率随着O3/NO摩尔比的增大而增大,当O3/NO摩尔比=1时,NO基本全部氧化为NO2,当O3/NO摩尔比>1时,部分NO2被氧化为NO3,NO3与NO2反应生成N2O5,但是由于N2O5性质不稳定,其生成和分解受到诸多因素影响。代绍凯等、Li等和Lin等的实验结果均符合上述结论。Wang等通过动力学模拟得到相同的结论,模拟结果如图3所示,NO在不同浓度时,均符合上述结论。
2.2反应温度
臭氧的热分解特性表明,反应温度过高会明显造成臭氧分解,为减少臭氧自身损耗,合理的反应温度为低于200℃时。在这个温度区间内,需要综合考虑氧化反应速率和氧化产物的分解程度。反应温度升高NO2和N2O5生成速率会加快,缩短了平衡时间。
O3与NO反应生成NO2速率很快,而且NO2性质稳定通常不会分解,因此反应温度对NO2的生成影响不大。但N2O5却受热易分解,需要控制反应温度。Wang等在O3/NO摩尔比为1.75,停留时间为5s的条件下模拟了温度对N2O5生成与分解的影响,发现温度超过110℃时N2O5就会明显分解,180℃时N2O5基本分解完全。
Lin等在O3/NO摩尔比为2,停留时间为5s的条件下进行氧化实验,发现反应温度低于60℃时反应速率较慢,温度区间为60~80℃时N2O5生成量较多,超过80℃后N2O5开始发生分解,150℃时基本分解完全。
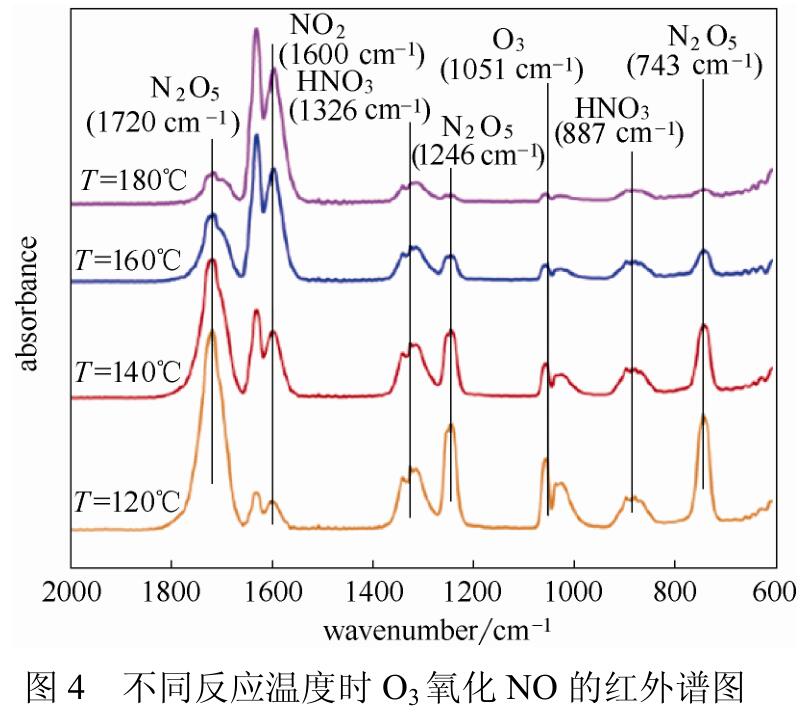
Sun等实验结果如图4所示,O3/NO摩尔比为1.5时,发现N2O5在温度超过120℃时开始明显分解,分解产物为NO2,180℃时N2O5和O3的红外峰消失,N2O5分解完全。
Stamate等在研究反应温度的影响中考虑了水的作用,当反应体系中引入水之后,同一反应条件下N2O5的最佳生成温度由80℃提高到了100℃,转化率由73.8%提高到85%。实验证明水的存在促进了NO2向N2O5的转化,他们认为造成这种现象的原因是水滴对N2O5的捕集作用。
基于以上实验,可以发现80~100℃是形成N2O5的最佳反应温度区间,反应温度低于80℃时氧化反应速率较慢,反应温度超过150℃时O3和N2O5会发生分解。为了定向调控氧化产物,需要合理地控制氧化反应温度。
2.3停留时间
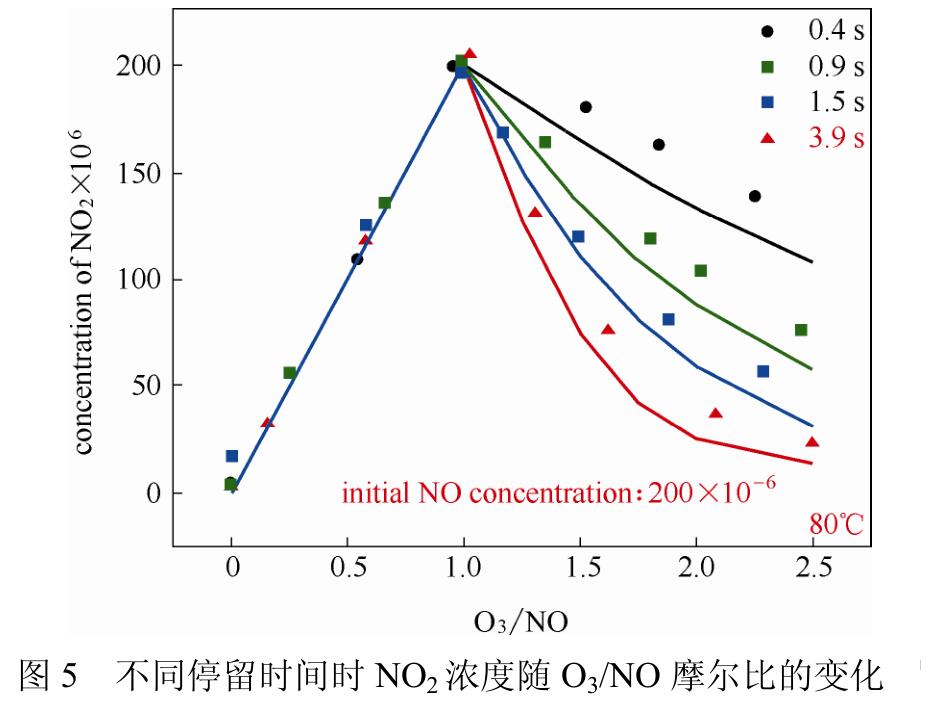
O3与NO生成NO2的反应很快,100℃时1s内即可达到反应平衡。Lin等的实验结果如图5所示,反应温度为80℃,O3/NO摩尔比<1,氧化产物为NO2,反应需要的停留时间少于0.4s,增加停留时间对NO2的生成影响不大。
Wang等模拟计算停留时间对生成NO2的影响,发现反应温度为100℃时,停留时间为0.417s时的氧化效率为73.56%,停留时间为1.25s时的氧化效率达到95.61%,继续增加停留时间对氧化效率的影响不明显。
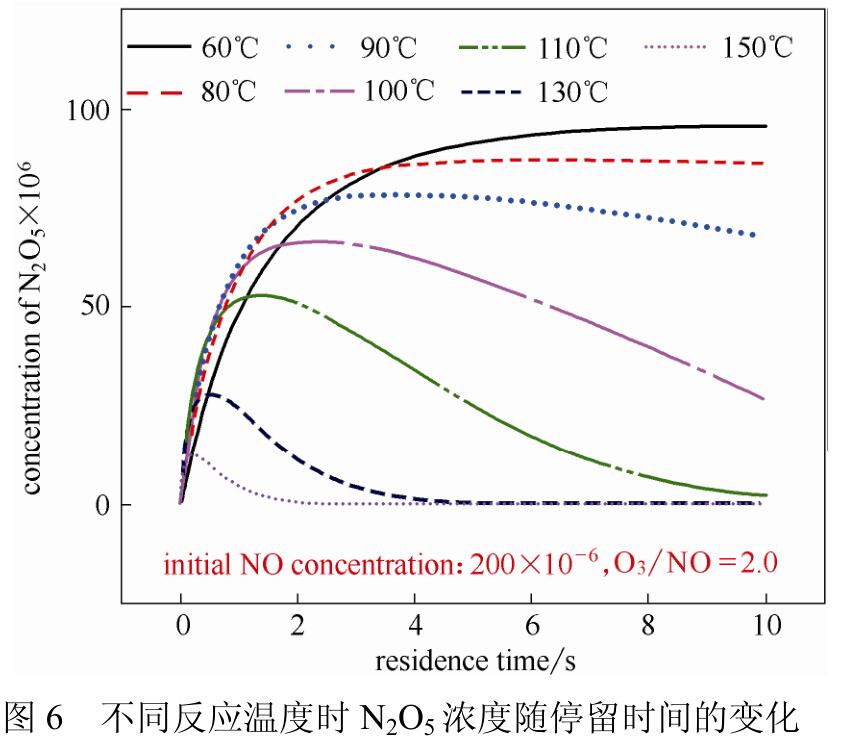
从前文中氧化机理可以看出形成N2O5的反应比形成NO2的反应慢很多,Lin等的模拟计算结果如图6所示,也证明了这一结论,当O3/NO摩尔比为2时,反应温度为60℃时需要5s的停留时间N2O5生成量才能达到稳定,而反应温度为80℃时则只需要3s,温度升高会缩短平衡时间,但超过100℃时N2O5就会明显发生分解。
Wang等模拟计算研究停留时间对生成N2O5的影响,O3/NO摩尔比为1.75时,反应温度为80℃时,随着停留时间增长,N2O5生成量逐渐增加,但是4~5s后生成速率增加变缓慢。
通过以上研究可以看出O3氧化NO生成NO2的反应速率很快,氧化产物NO2的化学性质比较稳定,不会受热分解。生成N2O5的反应速率则相对慢很多,且随着温度升高会发生分解,这也验证了氧化机理中限制N2O5生成的关键步骤为NO2氧化生成NO3的过程。
氧化产物调控技术研究中,影响氧化产物的主要因素是O3/NO摩尔比、温度和停留时间。其中O3/NO摩尔比决定了氧化产物种类,反应温度影响反应速率和氧化产物的存在状态,反应所需停留时间则与O3/NO摩尔比、反应温度有关。
3、脱硫系统中NOx的吸收
不同价态的NOx在溶液中吸收能力存在差异,相同价态的NOx也会由于吸收条件的不同影响吸收效率。研究吸收技术的目的是得到不同影响因素的作用原理,形成硫硝高效吸收系统。工业中常用的湿法脱硫工艺主要有石灰石-石膏法、氧化镁法、氨法和钠碱法等。
半干法脱硫工艺主要有循环流化床法(CFB)、旋转喷雾干燥法(SDA)以及密相干塔法(DFA-FGD等。不同的脱硫工艺其工艺参数差别较大,将氧化脱硝工艺应用于不同脱硫工艺中时,其影响脱硝效率的因素也存在差别。
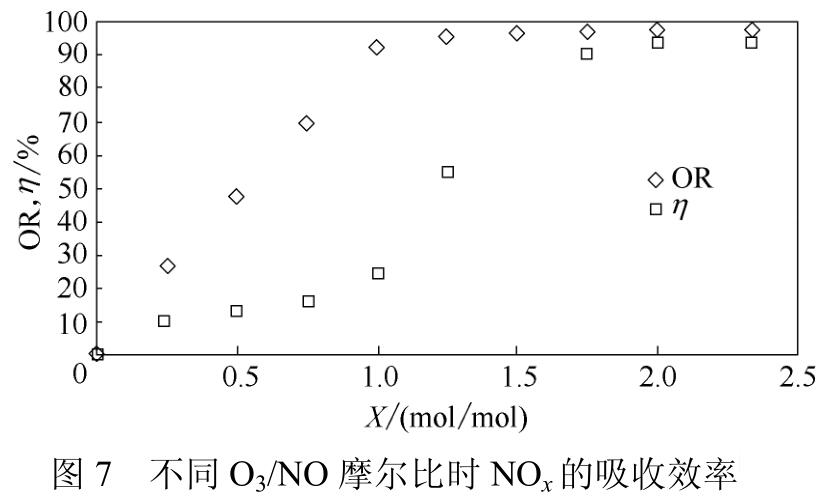
Jakubiak等采用NaOH溶液单独吸收NOx,实验结果如图7所示,发现NaOH溶液对NO2的吸收效率只有25%,N2O5吸收率可以达到90%以上,实验证明高价态NOx更易被碱性吸收剂吸收,但是实际脱硝过程中并非仅对N2O5进行吸收,更多的是对NO2进行吸收。目前实际工业应用的脱硫工艺中并无成熟的NO2吸收技术,这意味着亟需提高脱硫工艺对NO2的吸收效率。
3.1湿法吸收NOx研究
不同湿法脱硫工艺的区别主要是吸收剂种类不同,碱性吸收剂的作用原理是中和NO2与H2O反应形成的H+,促进NO2与H2O的反应。
常用的碱性吸收剂有Ca(OH)2、NaOH、Mg(OH)2和氨水等。结合工业中常用的吸收剂种类考虑,实验室主要针对Ca(OH)2、NaOH、Mg(OH)2等作为吸收剂进行了研究,而氨法脱硫工艺吸收NOx的研究非常少。
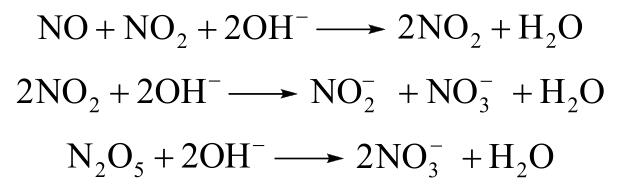
在碱性溶液中,NOx吸收过程发生的反应为
N2O5极易溶于水,很容易被吸收,因此,NOx吸收的难点主要集中在NO2的吸收,NO2吸收的研究主要针对吸收剂种类、吸收气体组成以及添加剂等因素对NO2吸收效率的影响。
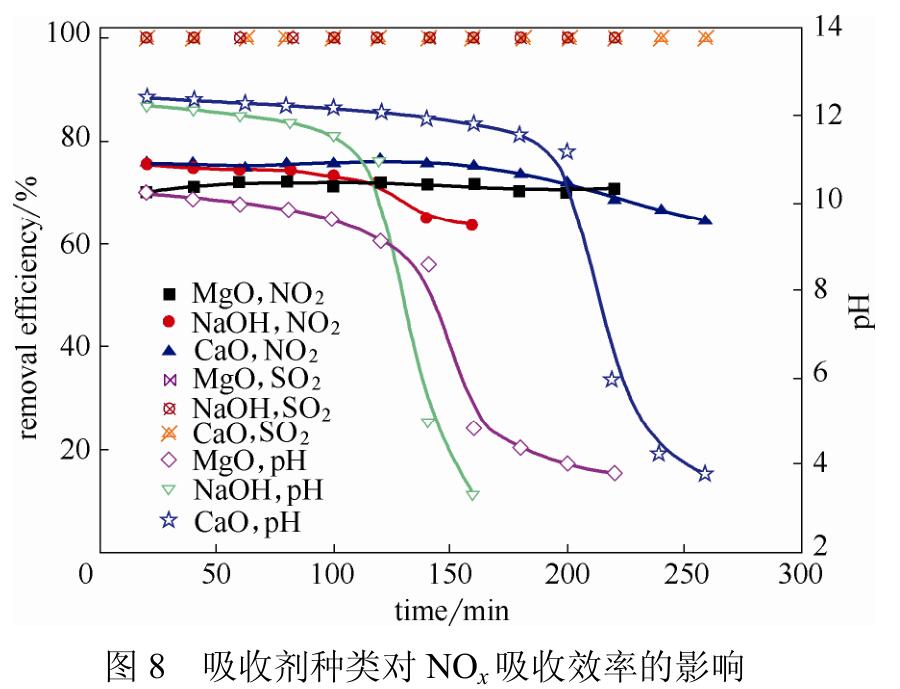
Sun等对比了MgO、CaO和NaOH三种吸收剂对NO2的吸收效率,如图8所示,发现有SO2存在时三种吸收剂对NO2的吸收率均在70%左右。实验证明吸收剂种类对于NO2吸收效率的影响不大,但是SO2却对NO2的吸收有很强的促进作用。
实际工程中主要应用碱性吸收剂,但研究中同样涉及还原性吸收剂。还原性吸收剂是利用SO32-的还原性与NO2发生氧化还原反应,达到脱除NO2的目的。SO2促进NO2吸收的作用原理与还原性吸收剂类似,利用脱硫产物SO32-的还原性。
Guo等采用氨溶液吸收NOx和SO2的混合气体,发现NOx对SO2吸收过程基本没有影响,但SO2对NOx吸收的促进效果明显。张相通过对比Na2SO3、Ca(OH)2和CaSO3三种吸收剂对NO2的吸收效率的影响,发现NO2的吸收效率随着SO32-的浓度的增加而提高。
Chen等选择Na2SO3溶液作为NO2的吸收剂,Gao等则选用亚硫酸铵和亚硫酸氢钠溶液作为NOx的吸收剂,均是由于NO2会与溶液中的SO32-和HSO3-发生氧化还原反应。
NO和NO2在脱硫工艺中吸收效率较低,向吸收液中添加一定的化学物质促进NO2的吸收成为一种可行的方案。
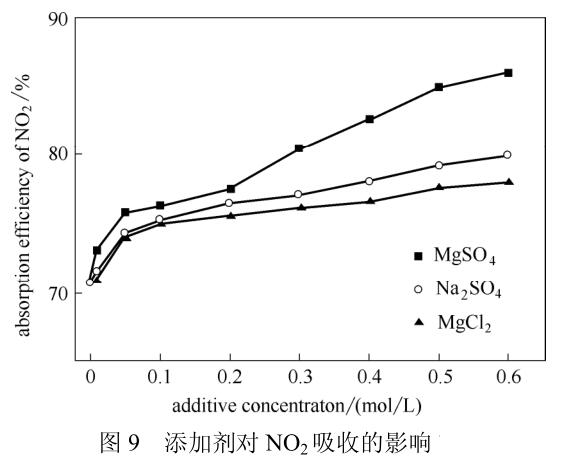
Tang等采用CaSO3作为吸收剂的原因是SO32-可与NO2反应促进NO2吸收。向CaSO3吸收液中添加三种吸收剂MgSO4、Na2SO4和MgCl2,实验结果如图9所示,对比三种添加剂对NO2吸收的促进作用,发现MgSO4效果最好。
因为SO42-与Ca2+结合形成更加难溶的CaSO4,溶液中游离出更多的SO32-与NO2反应,而且Mg2+与SO32-会生成MgSO3离子对,同样对NO2吸收有促进作用,实验证明Mg2+和SO42-对NO2吸收均有促进作用。
Sun等研究CaSO3溶液吸收NO2的添加剂的影响,同样发现MgSO4的促进效果最明显。Wang等通过对比不同添加剂对CaSO3浆液吸收NO2效率的影响,发现促进效果依次为:阳离子,Fe2+,NH+>Mn2+>,Fe3+Mg2+>;阴离子,SO32->4SO2->Cl-。
向吸收液中添加金属阳离子会影响吸收产物的利用,因此CaSO3浆液吸收NO2工艺中选择(NH4)2SO4作为添加剂是较好的选择,既能提高NO2的吸收效率,又不会影响吸收产物的利用。
马强研究湿法喷淋过程中I-对NO2脱除的促进效果,发现I-对NO2的脱除有很强的促进作用,而且I-可以抗烟气中氧气的氧化作用。孙承朗向镁基吸收液中添加抗氧化剂抗坏血酸(C6H8O6,Vc)。
王鸿等向氨溶液中添加抗氧化抑制剂S2O32-,抑制液相中SO32-的氧化,可以延缓NO2脱除效率随SO32-的氧化而降低。
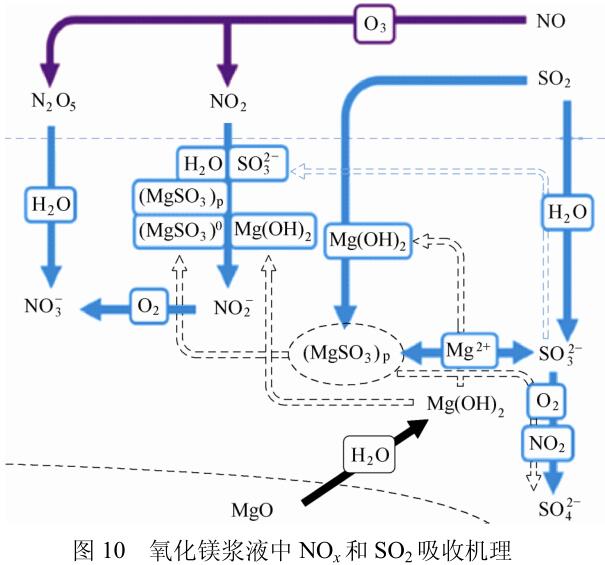
湿法脱硫工艺的氧化脱硝原理如图10所示,烟气中的SO2与脱硫剂反应被脱除,脱硫产物为SO32-。
烟气中的NO则被臭氧氧化成NO2和N2O5等高价态NOx,N2O5直接与H2O反应生成NO3-,而部分NO2被H2O吸收,其余的NO2则与脱硫产物SO32-发生氧化还原反应生成NO2-,最终被氧化成NO3-,达到脱除NOx的目的。
3.2半干法吸收NOx研究
工业中常用的半干法脱硫工艺包括循环流化床法(CFB)、旋转喷雾干燥法(SDA)以及密相干塔法(DFA-FGD)等。目前工业中尚无针对半干法脱硫工艺的氧化脱硝技术应用实例,实验室中利用半干法脱硫工艺进行氧化脱硝的研究也非常少。
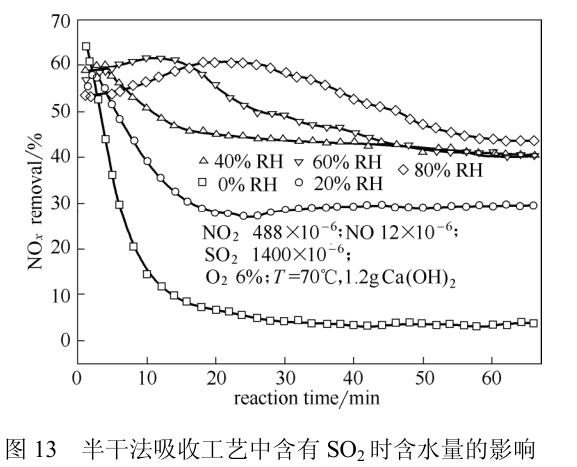
相比于湿法脱硫工艺的气-液两相反应,半干法脱硫则主要是气-液-固三相进行反应。由于半干法脱硫脱硫剂湿度较低,水在吸收剂颗粒表面形成一层液膜与气相中的SO2和NO2进行反应,因此在半干法脱硫工艺中脱硫剂湿度对脱硫脱硝效率起着至关重要的作用。Chen等采用固定床模拟半干法脱硫工艺,采用Ca(OH)2作为吸收剂吸收NO2和SO2。
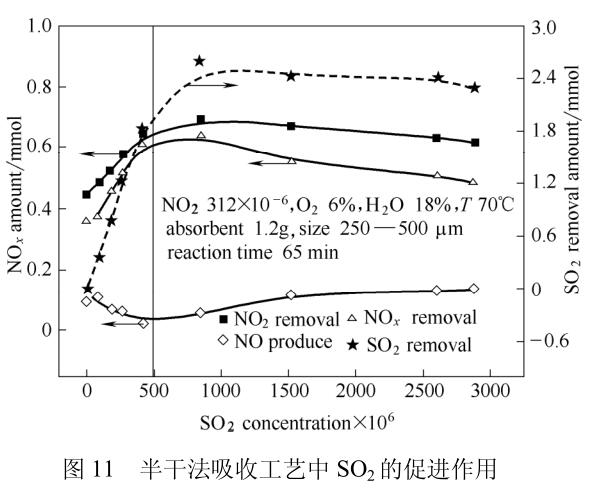
研究表明SO2对NO2的吸收有着很强的促进作用(图11),其促进作用原理与湿法吸收中SO2的促进作用原理相同,是在吸收剂表面的液膜中形成SO32-与NO2发生氧化还原反应。
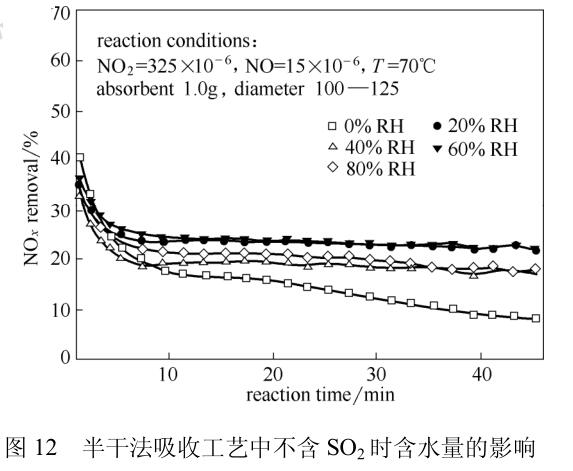
相对湿度的影响则通过对比有无SO2存在的条件下,相对湿度的大小对NO2吸收效率的影响(图12、图13),发现相对湿度对NO2的影响主要是在有SO2的条件下实现的,相对湿度的增大会促进NO2的吸收。
他们认为主要是由于相对湿度的增加促进了SO2的水解,增加了颗粒表面液膜中SO32-浓度,促进了NO2的吸收。
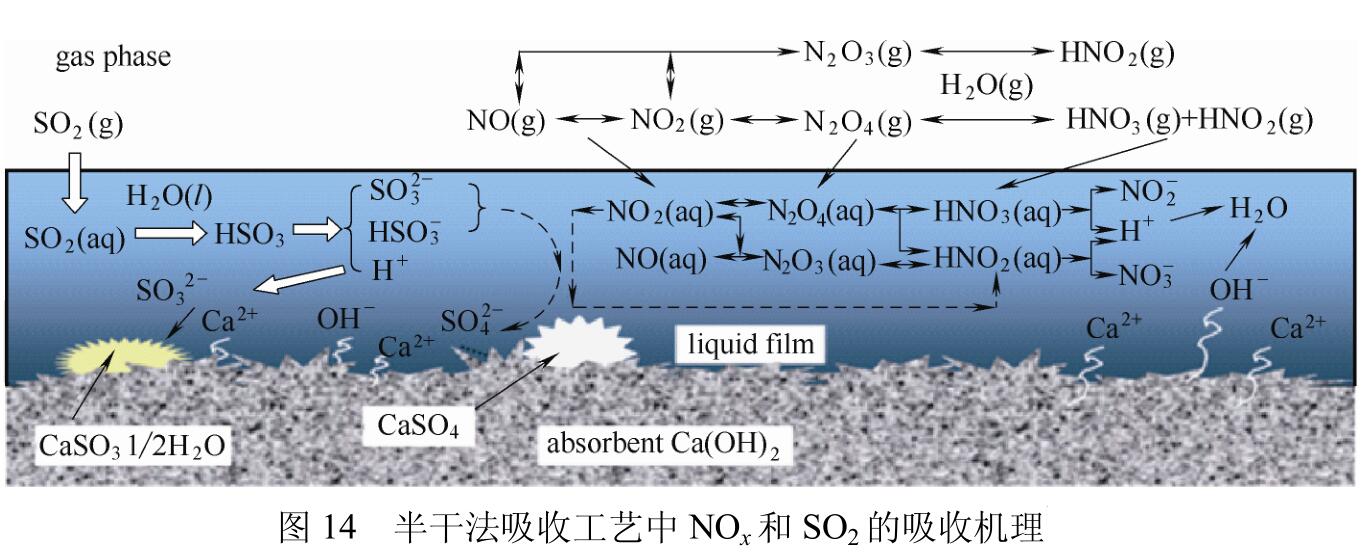
基于以上实验,他们提出了半干法脱硫工艺吸收NOx的作用原理,如图14所示。NO被氧化为NO2等高价态氧化物,在吸收剂表面的液膜中,部分NO2直接被水吸收,还有一部分NO2则是通过在液膜表面与脱硫产物SO32-发生反应被吸收。
湿法和半干法脱硫工艺吸收NOx,会因为脱硫工艺、吸收产物、吸收剂种类和添加剂等工艺参数的不同,对NOx吸收效率产生明显影响,因此研究NOx吸收过程中多因素的耦合作用机理,增强脱硫系统的脱硝性能,具有重要的研究意义。
4、存在问题和未来发展前景
目前的研究中尚存不足,主要可以归纳为以下几个方面:(1)复杂烟气组分中,O3氧化NOx过程中对SO2氧化的影响不明确;(2)影响氧化产物组成的因素研究中,H2O对生成N2O5促进作用机理尚不明确;(3)半干法脱硫工艺吸收NOx的相关研究太少,不能反映该工艺的特点。
总之,臭氧氧化脱硝技术的研究已经取得了较大突破,氧化吸收过程的反应机理以及氧化吸收效率的影响因素已经基本明晰,结合臭氧氧化吸收技术的工艺优势,其在工业应用中具有广阔的应用前景。
5、结论
本文主要介绍工业烟气氧化脱硝技术,重点分析各种工艺参数对氧化产物组成和吸收效率的影响。臭氧在复杂烟气组分中对NOx的氧化具有选择性。
O3/NO摩尔比、反应温度和停留时间会影响氧化产物的种类和组成。湿法脱硫工艺中SO2和添加剂对NO2的脱除有促进作用,尤其是脱硫产物SO32-,会与NO2发生氧化还原反应,促进效果明显。半干法脱硫工艺中NO2的脱除主要受水含量和SO2的影响。